Les systèmes d’interventions médicales doivent respecter une multitude d’éléments cruciaux et déterminer le compromis optimal entre la précision computationnelle, l’intégration des outils dans un environnement d’intervention ou opératoire hautement complexe et l’interaction en temps réel pour une rétroaction d’information adéquate. Ce second thème de recherche cherche à développer des solutions novatrices en suivi intra-opératoire d’outils médicaux et le recalage rigide ou déformable d’images. Nous nous concentrons sur des travaux révolutionnaires dans le guidage de microtransporteurs et d'interventions minimalement invasives afin de trouver des technologies adéquates pour faciliter la translation vers un contexte clinique. Les projets portent sur le recalage d’images multimodales automatisé et sur la détection et la localisation de cathéters et aiguilles.
CONFIRMATION PEROPÉRATOIRE DU CANCER PAR SPECTROSCOPIE RAMAN
Hiver 2023: David Grajales (Doctorat)
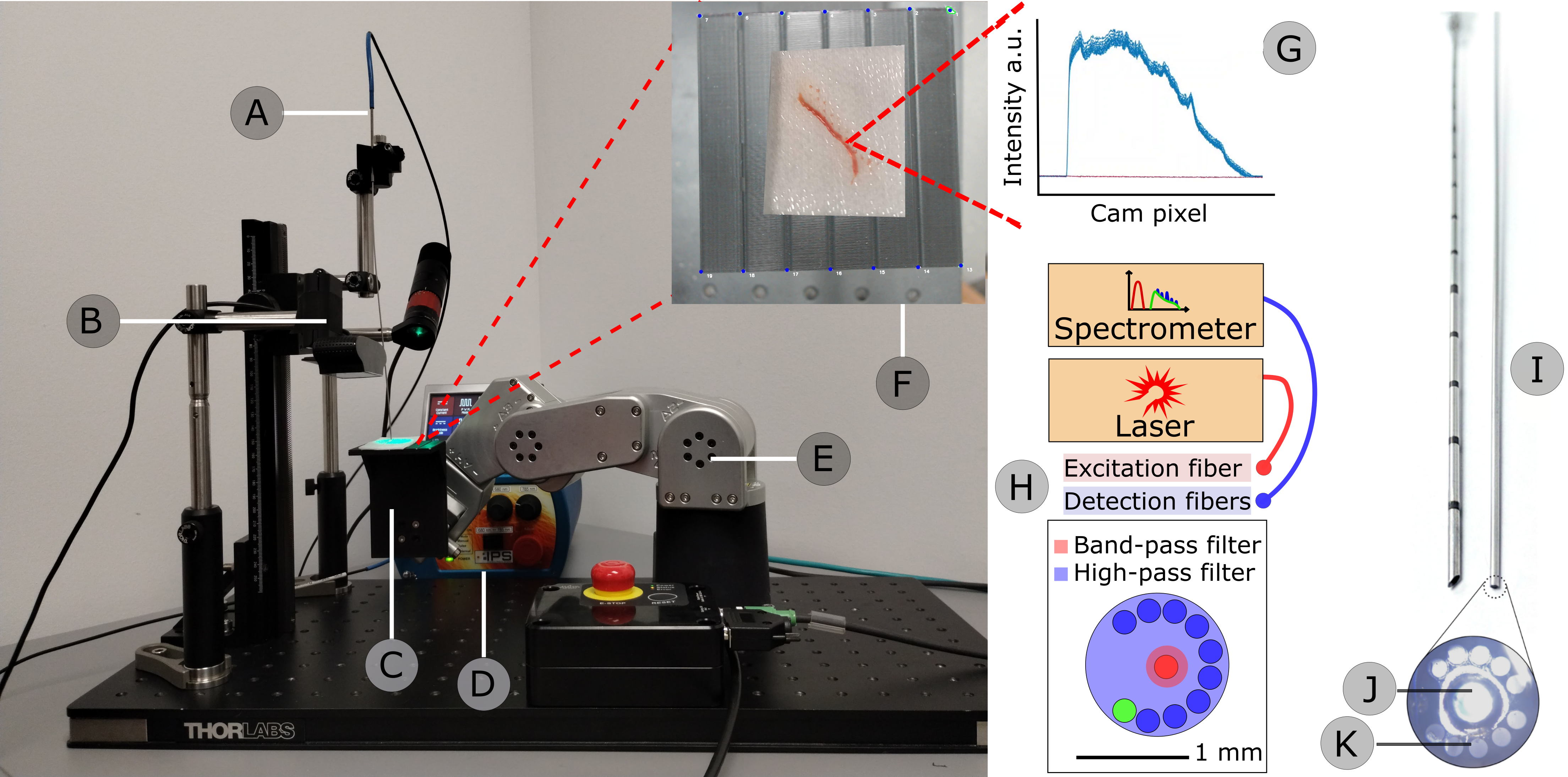
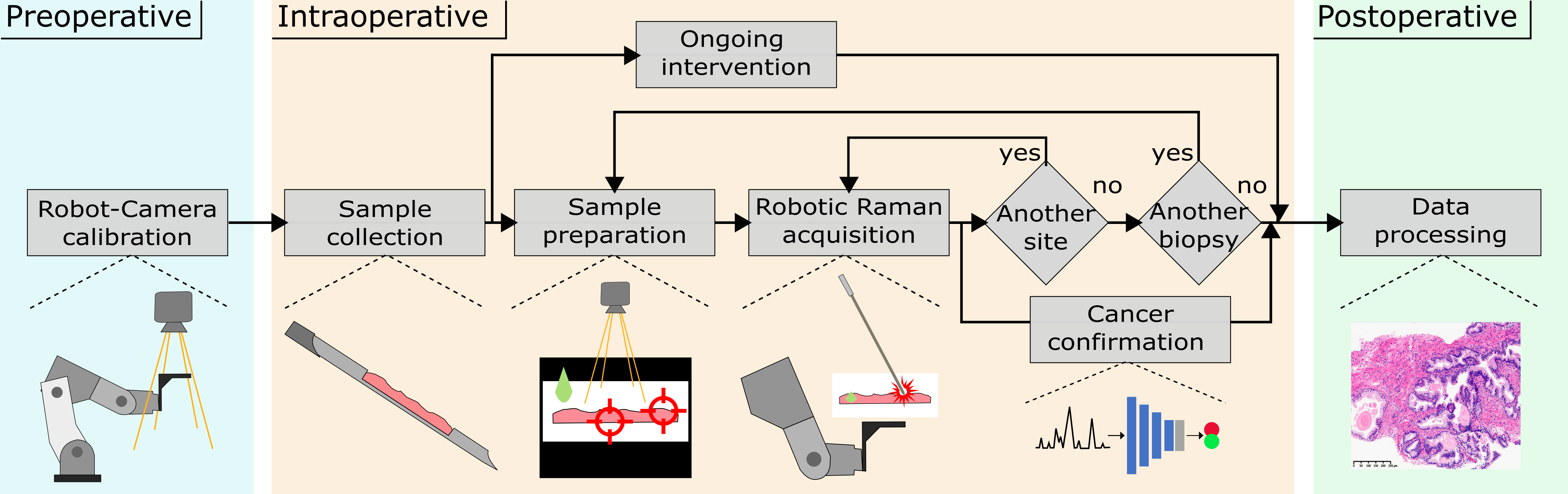
La confirmation du cancer en salle d'opération (OR) est cruciale pour améliorer le contrôle local des thérapies anticancéreuses. L'analyse histopathologique reste la référence, mais il y a un manque de confirmation in situ du cancer en temps réel pour étayer la confirmation des marges ou des tissus restants. La spectroscopie Raman (RS), en tant que technique optique sans étiquette, a prouvé sa puissance dans la détection du cancer et, lorsqu'elle est intégrée à un système d'assistance robotique, peut avoir un impact positif sur l'efficacité des procédures et la qualité de vie des patients, évitant ainsi une récidive potentielle.
Méthodes : Un flux de travail est proposé dans lequel un système robotique à 6 DOF (caméra optique + bras robotique MECA500) assiste la caractérisation d'échantillons de tissus frais à l'aide de RS. Trois méthodes d'étalonnage sont comparées pour le robot et l'efficacité temporelle est comparée à une analyse portative standard. Pour la discrimination des tissus sains/cancéreux, un réseau neuronal convolutionnel 1D est proposé et testé sur trois ensembles de données ex vivo (cerveau, sein et prostate) contenant la RS traitée et la vérité terrain histopathologique.
Soumission: MICCAI 2023
Le cancer de la prostate est un cancer prédominant chez l’homme qui cause toujours de nombreux décès. Heureusement, les programmes de dépistage mis en place par les autorités médicales permettent souvent une détection précoce de la maladie et de nombreux traitements sont disponibles. L’un de ces traitements, la curiethérapie à haut débit de dose, consiste en l’insertion d’une dizaine de cathéters dans la prostate via le périnée, la région entre l’anus et le scrotum, sous guidage d’un ultrason transrectal (TRUS). Ces cathéters sont ensuite utilisés pour introduire séquentiellement une source extrêmement radioactive dans l’organe suivant un plan toujours basé sur les images TRUS. Malheureusement, comme le contraste de l’ultrason ne permet pas de discerner les tissus affectés, cette technique ne permet pas un traitement focalisé au niveau de la tumeur. La prostate est donc irradiée uniformément, incluant les tissus sains.
Les tumeurs sont pourtant visibles sur les images de résonance magnétique (IRM) normalement acquises lors des étapes du diagnostic et de la planification préopératoire. Un recalage de ces images d’IRM vers le TRUS lors de l’intervention permettrait d’établir de nouveaux plans de traitement plus flexibles comme un traitement très focal ou encore une augmentation sélective de la dose dans la région de la tumeur. Plusieurs techniques de recalage intermodalité existent, mais leur application à la curiethérapie de la prostate pose plusieurs défis, notamment le faible contraste, la présence d’artéfacts causés par les cathéters et la déformation élastiques causée par la sonde transrectale. Ce projet propose de tirer profit des récentes avancées dans le domaine de l'apprentissage profond et particulièrement des réseaux neuronaux complètement convolutionnels pour surmonter ces difficultés.
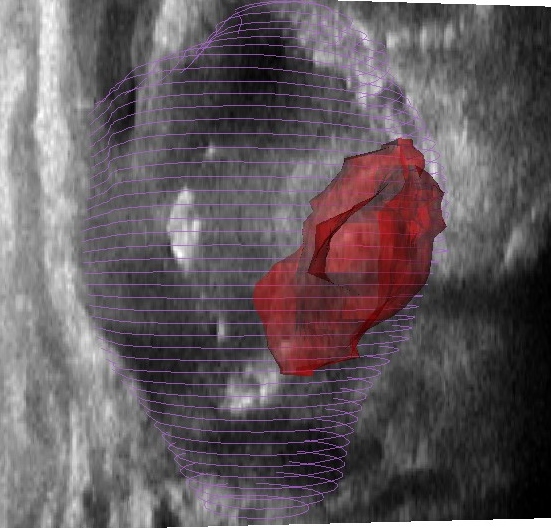
Les thérapies intra-artérielles, au cours desquelles un cathéter est introduit dans les artères du foie puis guidé jusqu’à la tumeur afin d’y injecter des agents anti-tumoraux, constituent actuellement le standard thérapeutique pour les cas avancés de cancers du foie primaires. Dans ce contexte, une modulation du taux d’injection des drogues en fonction des vitesses sanguines artérielles pourrait assurer leur infusion optimale dans les tissus cancéreux et ainsi optimiser la thérapie. Les ultrasons Doppler sont communément utilisés pour réaliser de telles mesures de flot sanguin. Cependant, les artères hépatiques sont difficiles à visualiser sur des images ultrasons (US). Nous proposons un outil qui facilite la visualisation de ces vaisseaux par US 3D en y intégrant un modèle 3D des artères hépatiques. Le modèle 3D est extrait d’images d’angiographie par résonance magnétique (MRA) en utilisant un algorithme automatique de segmentation développé dans notre laboratoire. Une méthode de recalage automatique multi-modalité est ensuite appliquée afin de fusionner le modèle 3D des artères à l’image ultrasons 3D et ainsi faciliter leur visualisation dans cette modalité.
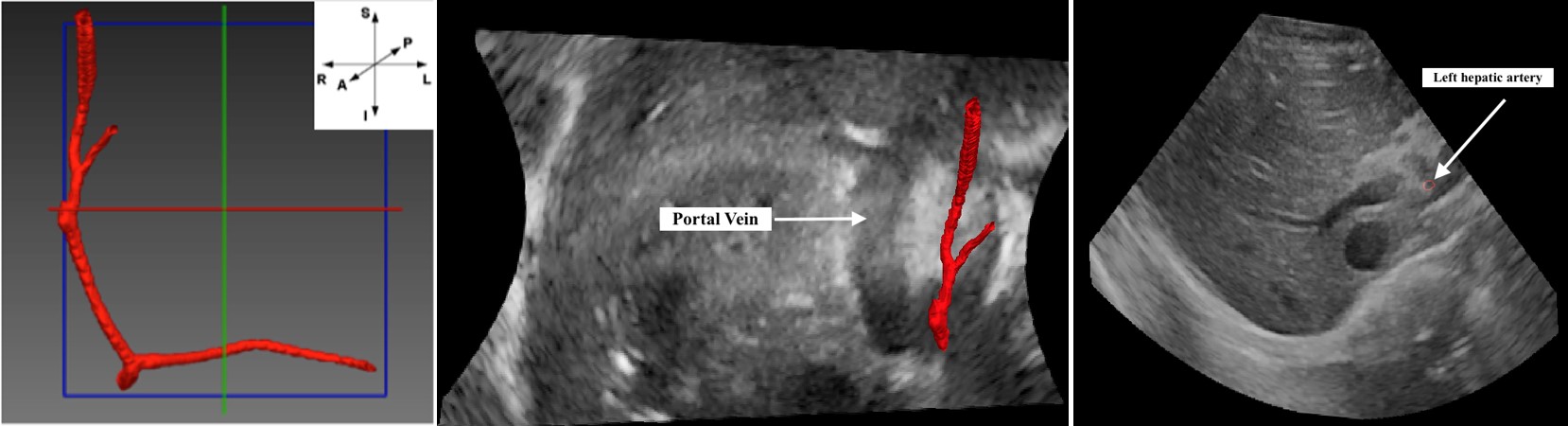
Ce projet vise à déterminer la précision avec laquelle la forme et la position de la pointe du cathéter peuvent être estimées sur la base de mesures FBG. À cette fin, une série de FBG sont intégrés dans trois fibres qui sont collées ensemble dans l'orientation de 120 degrés, puis insérées dans une canule. Par ailleurs, la segmentation des vaisseaux de l'image IRM, ainsi que l'enregistrement de l'image multimodale entre l'IRM préopératoire et l'image US intra-opératoire, seront également étudiés dans ce projet.

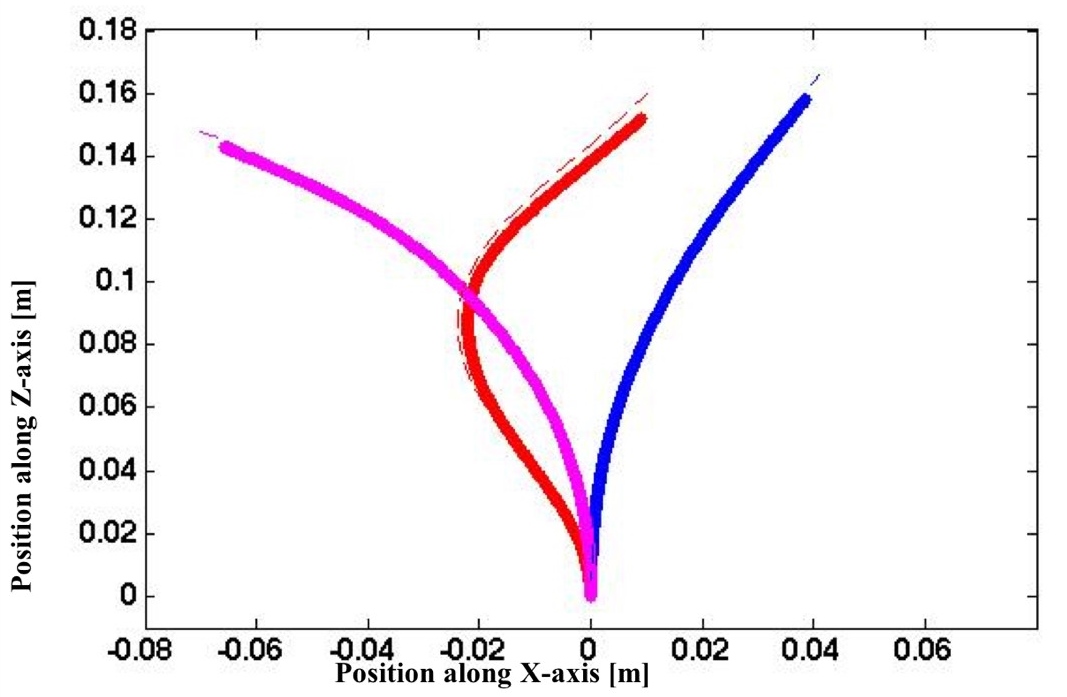
Lors d’interventions vasculaires utilisant des dispositifs intraveineux comme des cathéters, une visualisation en 3 dimensions et en temps réel de leur positionnement dans le corps est indispensable afin de s’assurer d’atteindre l’endroit ciblé (ex. cavités cardiaques). On utilise actuellement des procédés d’imagerie fluoroscopique à l’aide d’agent contrastant. Cela dit, ces procédés fournissent des images en 2 dimensions et faire une excellente représentation 3D à partir de séquences d’images demeure à ce jour une tâche ardue, sans mentionner que le temps d’exposition aux radiations peut s’avérer dommageable pour la santé des patients. C’est pourquoi ce projet se penche sur une méthode alternative qui se base uniquement sur l’insertion de fibres optiques dans les cathéters. L’utilisation de plusieurs FBGs comme senseurs de tensions permet alors de connaitre la courbure des cathéters aux endroits où sont inscrits les FBGs. Une approximation polynomiale d’ordre n+1 correspondant au nombre de senseurs utilisés permet ensuite de rapprocher le cathéter aux endroits exempts de réseaux de Bragg. Nos résultats préliminaires montrent que cette méthode peut mener à des dispositifs moins coûteux et plus sécuritaires que les dispositifs de modélisation actuelle (IRM, ultrason, etc.), sans pour autant perdre de précision. Au travers de ce projet, des efforts soutenus sont également déployés afin de minimiser ou de corriger la dépendance en température des senseurs et d’optimiser leur nombre et leur position.

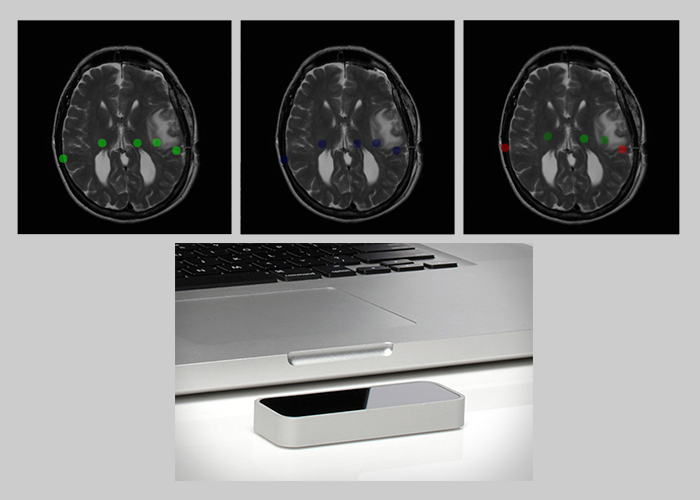
La radiologie interventionnelle a rendu l’utilisation de l’imagerie monnaie courante dans la pratique des médecins des centres hospitaliers. Pourtant, la navigation à travers les images médicales est loin d’être intuitive pour les médecins en raison du manque de contrôle des dispositifs actuels. L'objectif de ce projet est de développer un nouveau système de navigation permettant de naviguer à travers les scans médicaux par reconnaissance gestuelle, c'est-à-dire, sans aucun contact avec l'appareil afin de protéger la stérilité de la salle d'opération ou d'autopsie. La facilité d'utilisation et la performance de tels systèmes sont essentielles pour qu'ils soient adoptés par la communauté médicale. Le Leap Motion permet une détection fine des mouvements de la main ce qui évite les mouvements importants des membres supérieurs comme avec la Kinect. Cet avantage majeur en fait un outil très intéressant pour la reconnaissance de mouvements d’autant plus qu’il possède une taille réduite, un faible prix, ainsi qu’une forte communauté́ de développeurs. Un premier prototype peut être trouvé dans de ce répertoire.
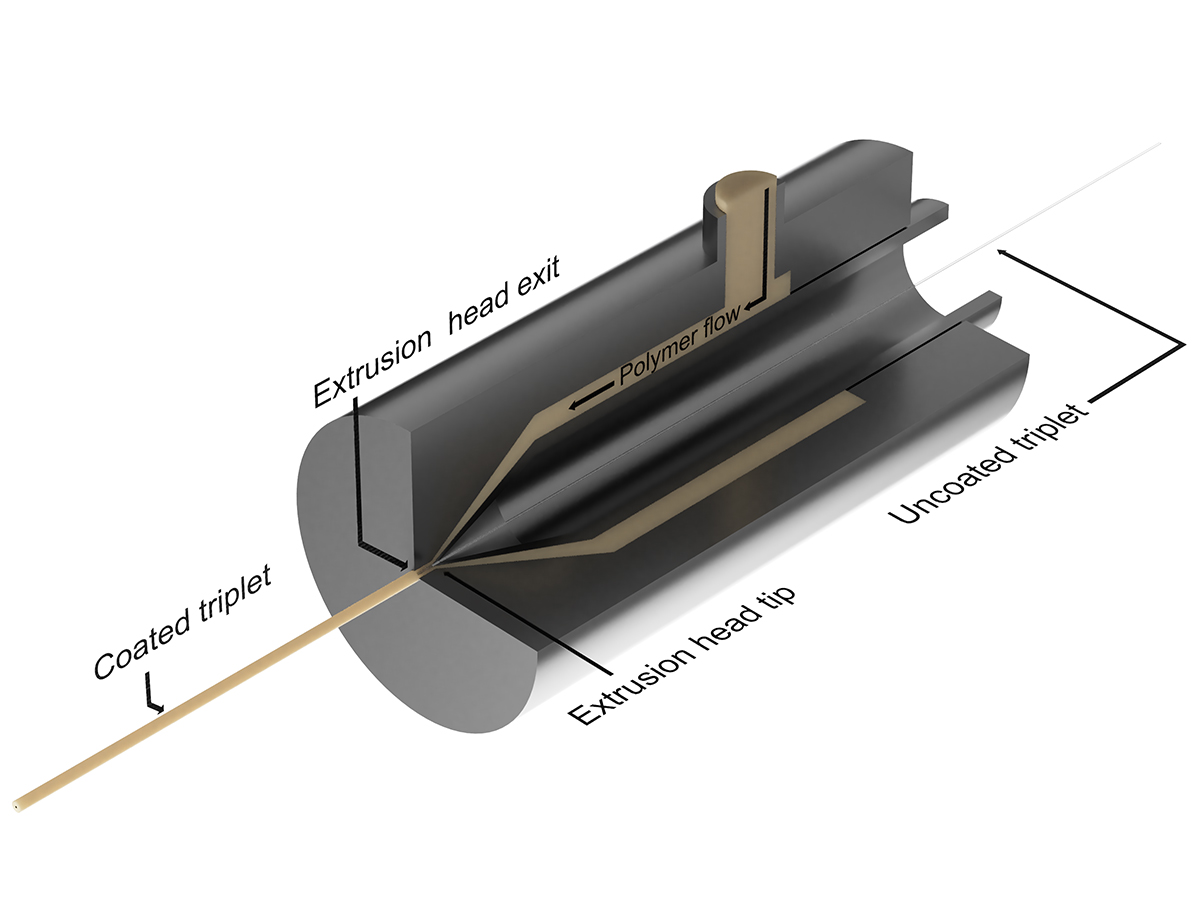
 Ce projet explore la possibilité d'utiliser le procédé d'extrusion pour fabriquer un nouveau type de capteurs biomédicaux à base de fibres optiques. Avec la méthode d'extrusion, un nombre illimité de fibres peuvent être intégrées dans le capteur pour répondre à différentes exigences. Le processus d'extrusion est connu pour sa fiabilité et permet la fabrication de n'importe quelle longueur de capteur sans problème de reproductibilité. L'accent est mis sur la détection de la forme des aiguilles et des cathéters pour la chirurgie mini-invasive. La détection de forme est effectuée en utilisant le signal de rétrodiffusion amélioré de nos ROGUE (réseaux de fibres optiques aléatoires écrits par exposition au laser UV ou ultra-rapides).
Ce projet explore la possibilité d'utiliser le procédé d'extrusion pour fabriquer un nouveau type de capteurs biomédicaux à base de fibres optiques. Avec la méthode d'extrusion, un nombre illimité de fibres peuvent être intégrées dans le capteur pour répondre à différentes exigences. Le processus d'extrusion est connu pour sa fiabilité et permet la fabrication de n'importe quelle longueur de capteur sans problème de reproductibilité. L'accent est mis sur la détection de la forme des aiguilles et des cathéters pour la chirurgie mini-invasive. La détection de forme est effectuée en utilisant le signal de rétrodiffusion amélioré de nos ROGUE (réseaux de fibres optiques aléatoires écrits par exposition au laser UV ou ultra-rapides).
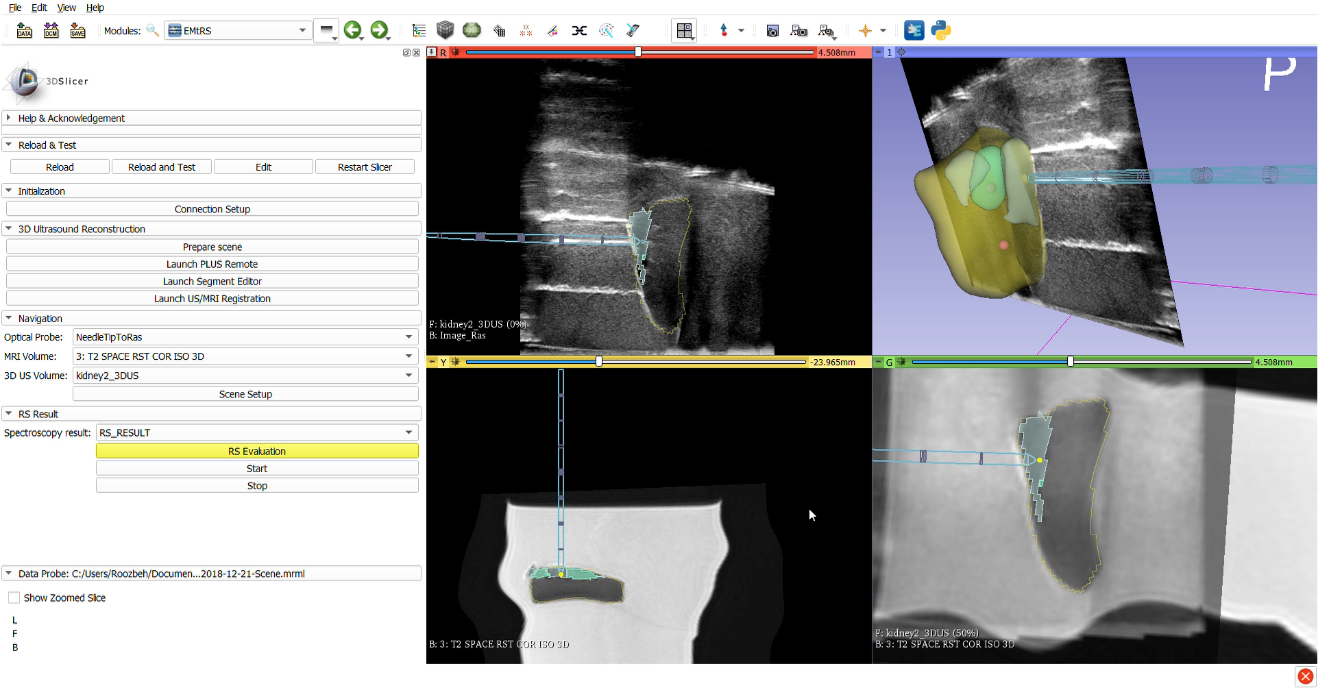
 Aux États-Unis, le cancer de la prostate représente 21% des nouveaux cas et 8% des décès estimés dus au cancer. Le type et le grade de la tumeur sont des informations essentielles pour déterminer la stratégie de traitement. Cependant, la procédure de biopsie de la prostate, qui est le standard de soins pour établir le diagnostic, souffre d'une précision limitée entraînant des biopsies faussement négatives chez jusqu'à 30% des patients. Dans cette étude, nous présentons un dispositif optique intégré pour le guidage des procédures de biopsie de la prostate, y compris une technique d'imagerie Raman qui a déjà démontré son potentiel pour le diagnostic du cancer en milieu clinique. La conception comprend un système d'imagerie multimodal basé sur la réflectance diffuse, la fluorescence et la spectroscopie Raman. Il fournit également une plate-forme de navigation basée sur l'imagerie par résonance magnétique (IRM) fusionnée avec des ultrasons 3D (US) en utilisant le suivi électromagnétique (EM). Le système est d'abord validé avec des expériences de tissus fantômes synthétiques et ex vivo. De plus, une méthodologie est proposée pour construire un modèle statistique à grande échelle pour distinguer le cancer du tissu normal et le tester in situ sur 30 patients humains.
Aux États-Unis, le cancer de la prostate représente 21% des nouveaux cas et 8% des décès estimés dus au cancer. Le type et le grade de la tumeur sont des informations essentielles pour déterminer la stratégie de traitement. Cependant, la procédure de biopsie de la prostate, qui est le standard de soins pour établir le diagnostic, souffre d'une précision limitée entraînant des biopsies faussement négatives chez jusqu'à 30% des patients. Dans cette étude, nous présentons un dispositif optique intégré pour le guidage des procédures de biopsie de la prostate, y compris une technique d'imagerie Raman qui a déjà démontré son potentiel pour le diagnostic du cancer en milieu clinique. La conception comprend un système d'imagerie multimodal basé sur la réflectance diffuse, la fluorescence et la spectroscopie Raman. Il fournit également une plate-forme de navigation basée sur l'imagerie par résonance magnétique (IRM) fusionnée avec des ultrasons 3D (US) en utilisant le suivi électromagnétique (EM). Le système est d'abord validé avec des expériences de tissus fantômes synthétiques et ex vivo. De plus, une méthodologie est proposée pour construire un modèle statistique à grande échelle pour distinguer le cancer du tissu normal et le tester in situ sur 30 patients humains.
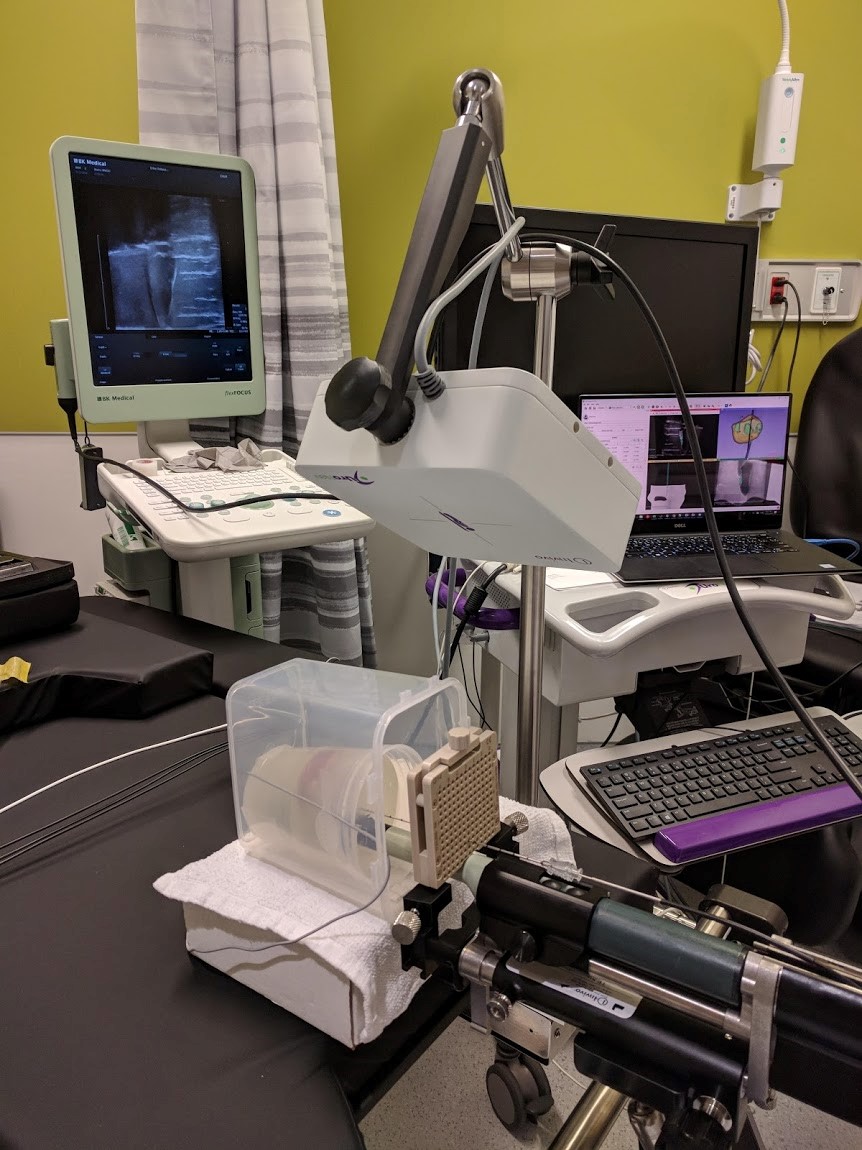
La biopsie est le standard de soins pour la confirmation du diagnostic de cancer de la prostate malgré ces taux élevés de faux négatifs et le temps nécessaire pour obtenir les résultats histopathologiques. En utilisant les propriétés optiques du tissu, la spectroscopie Raman a un grand potentiel pour la détection du cancer in vivo en temps réel. Le but de ce projet est de développer un logiciel de navigation comprenant la localisation de l’IRM préopératoire, de l’ultrason transrectal (TRUS) et de l’électromagnétisme (EM) intra-opératoire, et de mener une étude clinique pilote (étude de faisabilité) de la sonde optique pour la détection et la classification du cancer de la prostate.
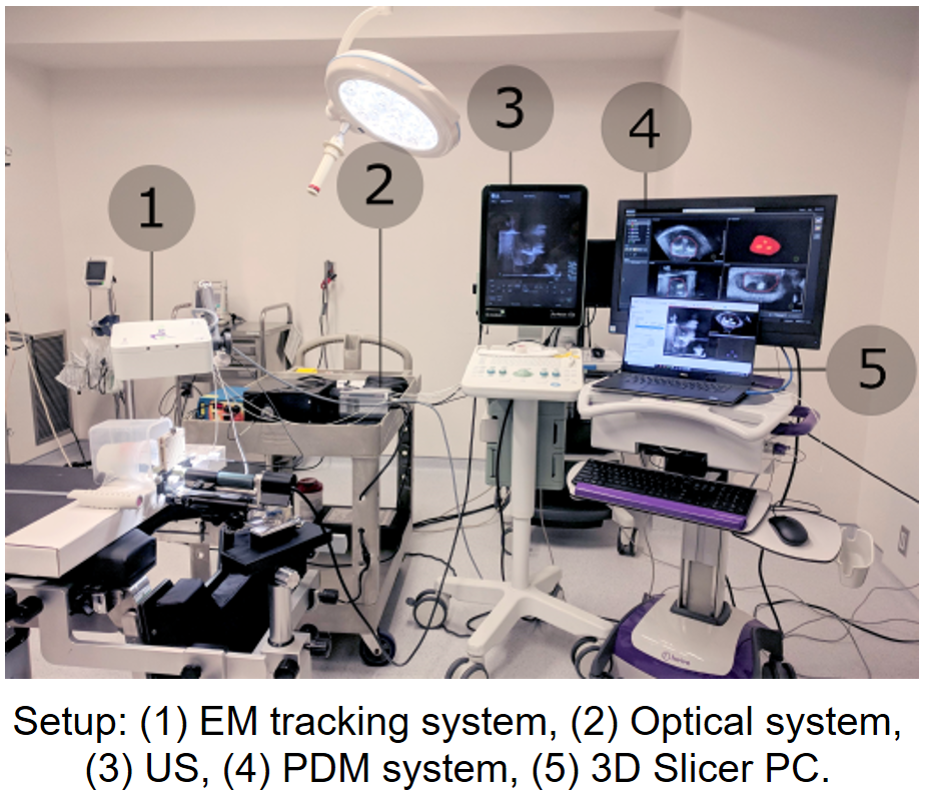
Les normes de soins standards en matière de biopsies et de thérapies pour le cancer de la prostate (CaP) reposent sur des procédures guidées par des ultrasons transrectaux intra-opératoires, mais cela conduit à des taux de faux négatifs pouvant aller jusqu'à 35%. Une approche prometteuse pour réduire les taux de biopsie négative consiste à tirer parti des propriétés optiques hautement sensibles et spécifiques du tissu prostatique. Son objectif serait alors de fournir à l'urologue ou au chirurgien des informations moléculaires in situ avant le prélèvement de l'échantillon. Fournie en temps réel pendant l'insertion de l'aiguille de biopsie, cette nouvelle collecte de données pourrait permettre un ciblage plus précis de la tumeur et, par conséquent, une diminution du taux de faux négatifs. La spectroscopie Raman (SR) est une technologie optique qui a démontré sa capacité à discriminer les tissus malins des tissus normaux. Elle a été réalisée in vivo avec succès lors de résections de tumeurs cérébrales. Dans ce projet, nous visons à concevoir et à construire un système de navigation pour SR qui puisse être utilisé in situ avant l'extraction des tissus pour confirmer la présence de CaP. Ce système utilisera le suivi électromagnétique et la fusion IRM/ultrasons pour naviguer vers la cible, et la SR pour détecter le tissu cancéreux.