
Le Magazine de Polytechnique Montréal
La microfluidique au renfort de la détection performante de maladies
Recherche
Le Pr Thomas Gervais, du département de génie physique de Polytechnique Montréal, ainsi que ses étudiants au doctorat Pierre-Alexandre Goyette (génie biomédical) et étienne boulais (génie physique) ont mis au point, avec la collaboration de l’équipe du Pr David Juncker, du département de génie biomédical de l’Université McGill, un nouveau procédé microfluidique visant l’automatisation de la détection de protéines par des anticorps. Ces chercheurs ont, par la même occasion, adapté une théorie mathématique récente permettant la modélisation du procédé.
Leurs travaux, qui font l’objet d’une publication dans la prestigieuse revue nature communications, annoncent l’avènement prochain de nouveaux instruments portatifs pour accélérer le processus de criblage et l’analyse de molécules dans les laboratoires de biologie, dans le but notamment d’accélérer la recherche en biologie du cancer.
De la microfluidique conventionnelle à la microfluidique en milieu ouvert
La microfluidique désigne la manipulation des fluides dans des dispositifs à l’échelle micrométrique. Communément appelés « laboratoires sur puce », les systèmes microfluidiques permettent l’étude et l’analyse d’échantillons chimiques ou biologiques à très petite échelle, en remplaçant les très coûteux et volumineux instruments servant aux analyses biologiques traditionnelles. La microfluidique est considérée comme une révolution pour la biologie et la chimie de même ampleur que celle que les microprocesseurs ont fait vivre au domaine de l’électronique et de l’informatique, et elle s’adresse à un énorme marché.
Aujourd’hui, cette jeune discipline qui a pris son essor à partir des années 2000, en se développant avec des dispositifs fermés composés de réseaux de microcanaux, se trouve elle-même transformée par la découverte de l’équipe du Pr Gervais, qui renforce les fondements théoriques et expérimentaux de la microfluidique en milieu ouvert.
Cette dernière, qui élimine les canaux, concurrence avantageusement la microfluidique conventionnelle pour certains types d’analyses. La configuration des dispositifs microfluidiques en canaux fermés présente en effet plusieurs désavantages : l’échelle des sections transversales des canaux augmente le stress que les cellules subissent lorsqu’elles sont cultivées; et ces dispositifs ne sont pas compatibles avec le standard de la culture cellulaire, le plat de Pétri, ce qui fait que l’industrie peine à l’adopter.
La nouvelle approche explorée à Polytechnique consiste en un système d’injection et d’aspiration simultanée de liquides par des micro-ouvertures opposées sur une toute petite surface placée dans un espace confiné de moins de 0,1 mm d’épaisseur. « En s’entrechoquant, ces jets de fluides forment des motifs que l’on peut visualiser en les colorant grâce à des réactifs chimiques. Nous avons voulu comprendre ces motifs tout en développant une méthode fiable de modélisation de multipôles microfluidiques (MMF) », déclare le Pr Thomas Gervais.
D’élégantes symétries visuelles qui rappellent l’œuvre de l’artiste M. C. Escher
Pour parvenir à comprendre ces motifs, l’équipe du Pr Gervais a dû développer une nouvelle théorie mathématique dite des écoulements multipolaires ouverts. Cette théorie s’appuie sur une branche classique des mathématiques appelées transformations conformes qui permet de résoudre un problème lié à une géométrie complexe en la réduisant à une géométrie plus simple (et vice versa).
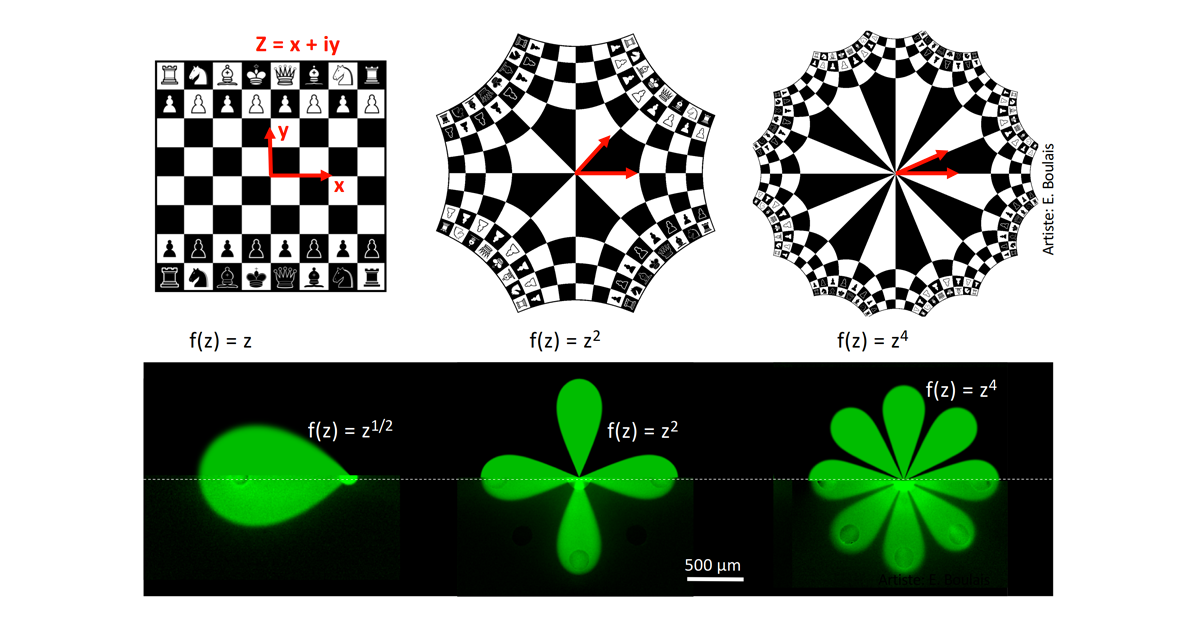
Illustration de l’effet des transformations mathématiques utilisées, d’abord sur l’image d’un jeu d’échec, puis sur les multipôles microfluidiques
Le doctorant Étienne Boulais a d’abord développé un modèle permettant d’étudier les collisions de microjets dans un dipôle microfluidique (donc un MMF à seulement deux ouvertures), puis en s’appuyant sur cette théorie mathématique, a extrapolé le modèle à des MMF à ouvertures multiples.
« Passés par la transformation conforme, les motifs formés par la collision de jets de fluides forment des images symétriques qui rappellent les tableaux du peintre hollandais Maurits Cornelis Escher », explique le jeune chercheur, passionné par les arts visuels. « Mais bien au-delà de son aspect esthétique, notre modèle permet de décrire la vitesse de déplacement des molécules dans les fluides ainsi que la concentration des réactifs. Nous avons défini des règles valables pour toutes les configurations possibles de systèmes allant jusqu’à 12 pôles, afin de générer une large variété de modèles d’écoulement et de diffusion. »
La méthode se présente donc comme une boîte à outils complète qui permettra non seulement de modéliser et d’expliquer les phénomènes en action dans les MMF, mais aussi d’explorer de nouvelles configurations. Grâce à cette méthode, il devient dorénavant possible d’automatiser les essais microfluidiques en espace ouvert sur de grandes surfaces en simultané, ce qui n’avait jusqu’ici jamais été autrement exploré que par essai et erreur.
Fabrication du dispositif en impression 3D
Le dispositif MMF conçu et fabriqué par Pierre-Alexandre Goyette se présente comme une petite sonde, fabriquée en résine par un procédé d’impression 3D bon marché et reliée à un système de pompes et d’injecteurs.
« L’expertise de l’équipe du Pr Juncker en détection de protéines par des anticorps immobilisés sur une surface nous a aidés à gérer les aspects biologiques de ce projet », souligne le doctorant en génie biomédical. « Avec les résultats des essais, nous avons pu valider l’exactitude des modèles développés par mon collègue Étienne. »
Le dispositif autorise l’utilisation simultanée de plusieurs réactifs pour détecter différentes molécules dans un même échantillon, ce qui fait gagner un temps précieux aux biologistes. Pour certains types de tests, le temps d’analyse pourrait ainsi être réduit de plusieurs jours à quelques heures, voire quelques dizaines de minutes. En outre, la polyvalence de cette technologie devrait la rendre exploitable pour divers processus d’analyse, entre autres des tests immunologiques ou d’ADN.

Dispositif microfluidique fabriqué par impression 3D et images de motifs microscopiques de fluides créés à l’aide de solutions fluorescentes : a) Multipôle concentrique de type fleur (impression 3D); b) Multipôle en damier (impression 3D); c) Image en fluorescence de multipôle de type fleur; d) Image en fluorescence de multipôle de type damier.
Vers un afficheur microfluidique ?
L’équipe du Pr Gervais envisage déjà une prochaine étape à son projet : le développement d’un écran sur lequel s’afficherait une image chimique. « Il s’agirait d’une sorte d’équivalent chimique de l’afficheur à cristaux liquides », explique Thomas Gervais. « De la même façon qu’on déplace des électrons sur un écran, on enverrait ici des jets de fluide à diverses concentrations qui réagiraient avec une surface. L’ensemble formerait une image. Nous avons très hâte de poursuivre ce projet pour lequel nous avons obtenu un brevet provisoire. »
Un renouveau des procédés de diagnostic et de suivi des traitements médicaux
Pour l’instant, la technologie développée par cette équipe de recherche s’adresse au marché de la recherche fondamentale. « Nos procédés permettent d’exposer des cellules à de nombreux réactifs en parallèle. Ils pourront aider les biologistes à étudier à grande échelle les interactions entre les protéines et les réactifs, en augmentant la quantité et la qualité d’informations obtenues durant les essais », affirme le Pr Gervais.
Celui-ci précise que dans un deuxième temps, le marché pharmaceutique pourra également bénéficier des nouvelles méthodes d’automatisation des systèmes de criblage qui découleront de la découverte. Enfin, celle-ci ouvre une nouvelle porte à la découverte de médicaments, en facilitant la culture des cellules de patients et leur exposition à différents agents médicamenteux pour déterminer celles qui répondent le mieux.


 disponible (Printemps 2019)
disponible (Printemps 2019)


