Le Magazine de Polytechnique Montréal
Des nanomatériaux pour mieux nous soigner
Grand Dossier
Les professeures Géraldine Merle et Nancy Tawil, deux spécialistes en nanotechnologies pour la santé
Ils aident les cartilages à se régénérer, les os à se ressouder, le muscle cardiaque à fonctionner, ils libèrent des vaccins, éliminent des colonies de bactéries, piègent des cellules cancéreuses, etc. : les nanomatériaux sont en train de transformer la médecine. Le développement de ces matériaux interagissant avec nos fonctions biologiques amenuise les frontières entre l’ingénierie et les sciences de la santé. Quelques-uns des nombreux chercheurs de Polytechnique actifs dans ce domaine nous dévoilent certains de leurs projets porteurs de fantastiques promesses thérapeutiques.
Administration contrôlée d’agents antibactériens
Pre Nancy Twail, Département de génie mécanique
L’augmentation de l’âge moyen de la population stimule la demande en interventions orthopédiques chaque année. À titre d’exemple, en 2018-2019, plus de 62 000 arthroplasties de la hanche et près de 75 400 arthroplasties du genou ont été réalisées au Canada, représentant des hausses respectives de 20,1 % et de 22,5 % depuis 5 ans, selon un rapport récent de l’Institut canadien d’information sur la santé. Ce type d’intervention qui change la vie des patients montre cependant un risque de complications dont les conséquences peuvent être graves : des infections résistantes aux traitements antibiotiques standards.
Ces infections sont principalement causées par la formation de biofilms bactériens qui se développent sur les implants. Il s’agit de colonies de micro-organismes qui se protègent de leur environnement en sécrétant une enveloppe de polymères très résistante. Les biofilms sont à l’œuvre dans 80 % des infections nosocomiales.
« Les infections périprothétiques imposent un fardeau important au patient et au système de santé. Ce problème peut impliquer le retrait de la prothèse et la mise du patient sous traitement antibiotique à dose élevée pendant un ou deux ans. Cette révision implique la mise en place d’un espaceur imprégné d'antibiotique qui occupera la place de la prothèse afin d'éviter la rétraction des tissus entourant l'articulation. L’intervention entraîne une perte de motricité et de qualité de vie pour le patient. Même après un traitement antibiotique et la pose d’une nouvelle prothèse, plus de la moitié des nouvelles prothèses redeviennent infectées par des bactéries résistantes aux antibiotiques. Cela se traduit par un taux d’amputation majeur, une morbidité importante : plus de 10 % de mortalité à un an, ainsi que des taux d'échec atteignant 50 % lorsque l'implant est conservé », indique la Pre Nancy Tawil, du Département de génie mécanique. Cette spécialiste en dispositifs médicaux antibactériens dirige des projets de développement de systèmes de libération prolongée de bactériophages, dont certains visent à contrer les infections d’implants orthopédiques.
Les bactériophages sont des virus qui infectent des bactéries spécifiques, se répliquent à l'intérieur de celles-ci et mènent à leur destruction. Leur utilisation peut donc donner lieu à des stratégies extrêmement ciblées et efficaces contre les infections microbiennes, notamment lorsqu’on les associe à des traitements antibiotiques. Les bactériophages présentent toutefois un défi de stabilité et de durée de survie assez courte dans l’organisme. Il faut à peine une heure pour que le système immunitaire les désactive.
C’est ici que l’ingénierie des biomatériaux entre en scène, avec la conception d’un système de libération du cocktail bactériophages-antibiotiques à l’endroit où il doit agir. « Nous les micro-encapsulons dans des polymères biodégradables, produits à base d’aminoacides naturels, qui vont libérer ces cocktails dans un délai que l’on peut contrôler. La libération de bactériophages permettra d’éliminer les bactéries qui auraient commencé à migrer dans le corps ou à s’incruster sur les implants pour former des biofilms », explique la Pre Tawil.
La fabrication des matériaux employés par l’équipe de Mme Tawil pour développer ces systèmes étant relativement peu coûteuse, le prix de revient de ces systèmes n’est donc guère un enjeu. Ce qui l’est, en revanche, c’est de prévoir des stratégies assez robustes pour être compatibles avec les interventions de chirurgie orthopédique qui impliquent des manipulations assez « musclées ». « Nous explorons deux avenues : le dépôt sur l’implant de bactériophages encapsulés dans des polymères à libération lente, en recourant à une méthode de plasma; la deuxième consiste à la mise au point d’une formule en aérosol, voire en poudre, que le chirurgien pourra vaporiser sur l’implant et autour de celui-ci. » Des études cliniques en cours montrent des résultats très encourageants.
L’équipe cherche aussi à développer des timbres (patches) ainsi que des pansements en polymères contenant les microcapsules, qui pourraient être employés pour la désinfection des plaies. « Nous avons observé sur des modèles animaux que ce système de polymères aminoacides associé au cocktail bactériophages-antibiotiques accélère la guérison des plaies de 30 % en activant le système immunitaire », rapporte Nancy Tawil. Autre avantage, l’emploi de ces formules en timbres, en aérosol ou en pansements ne demanderait que quelques secondes au personnel hospitalier. Ces projets sont actuellement en phase clinique en collaboration avec la Clinique Mayo aux États-Unis, un centre hospitalier de Miami et une association américaine d’anciens combattants.

Timbre de polymère avec bactériophages encapsulés
Découverte imprévue
Pr Nick Virgilio
En sciences, il arrive que des expériences menées sur un mode ludique apportent des connaissances utiles à des projets très sérieux. C’est ce qui s’est passé en 2012 dans le laboratoire du Pr Virgilio, un expert en polymères, microstructures et interfaces de la matière molle, au Département de génie chimique. Avec un de ses étudiants, il s’est amusé à plonger des hydrogels, formés à partir d’un polymère biosourcé issu d’algues, dans différents solvants pour observer ce qui se passait. L’expérience leur a permis de découvrir qu’à la différence de la plupart des polymères qu’il utilisait jusque-là, cet hydrogel ne se dissolvait pas dans un solvant organique.
« Mon collègue Pierre Sarazin, aujourd’hui chez PolyExpert inc., et moi avons eu l’idée de façonner un moule à partir d’un autre polymère, soluble celui-ci, dont la structure présente de petits pores entièrement interconnectés, que nous avons remplis, telle une éponge, avec l’hydrogel », rapporte le Pr Virgilio. « Ensuite, nous avons utilisé un solvant sélectif qui a dissout le moule, laissant intact l’hydrogel présentant les mêmes caractéristiques microstructurales que le moule. Avec ce procédé, nous pouvons obtenir différentes formes de microstructures d’hydrogel que j’utilise dans divers projets. »
Prisons de polymère pour cellules cancéreuses
Le Pr Nick Virgilio emploie notamment cet hydrogel poreux dans un étonnant projet mené en collaboration avec des chercheurs de l’Université de Sherbrooke : le piégeage de cellules tumorales de glioblastome pour éviter les récidives du cancer du cerveau. « Benoît Paquette, professeur au Département de médecine nucléaire et de radiobiologie de l’Université de Sherbrooke, souhaitait mettre au point un système pour renverser l’évasion des cellules de glioblastome, un cancer cérébral dont le taux de récidive demeure élevé après intervention, explique-t-il. La chirurgie échoue souvent à retirer les cellules cancéreuses en périphérie de la tumeur. Elles finissent par se disperser et proliférer dans le cerveau. Benoît s’est intéressé aux moyens de diriger ces cellules vers un piège qui serait déposé dans la cavité chirurgicale une fois la tumeur extraite. »
Pour construire un tel piège, le Pr Paquette a fait appel à l’expertise de Nick Virgilio, et à celle de deux chercheurs du Département de génie chimique et biotechnologique de l’Université de Sherbrooke, la Pre Nathalie Faucheux, spécialiste en biomatériaux fonctionnalisés et en phénomènes d’interface cellules-biomatériaux, et le Pr Marc-Antoine Lauzon, spécialiste en génie tissulaire. Les Prs Faucheux et Lauzon jouent un rôle essentiel dans le développement d’un système d’attraction qui s’appliquera à toutes les cellules du glioblastome et qui tiendra compte des spécificités physiologiques du cerveau. Leurs contributions permettront aussi d’adapter l’hydrogel afin d’assurer la rétention des cellules cancéreuses, une étape clé pour garantir l’efficacité de la stratégie proposée.
« Le cerveau étant un tissu très mou, nous avons choisi comme matériau un hydrogel poreux, qui présente des propriétés mécaniques comparables. Un chimio-attracteur à libération graduelle y est ajouté afin d’attirer les cellules. Je travaille à mettre en forme et à contrôler la microstructure de l’hydrogel pour que les cellules cancéreuses y entrent et s’y accumulent, et y demeurent attachées, de façon à ne pas pouvoir ressortir, comme si elles étaient piégées dans un labyrinthe. Nous devons voir ensuite si des séances de radiothérapie peuvent éradiquer les cellules ainsi bloquées », indique le Pr Virgilio.
Le chercheur souligne que le projet présente un grand nombre de défis et d’aspects à étudier : l’efficacité du composé qui doit attirer les cellules cancéreuses, la distance à laquelle il fait effet sur ces cellules dans des conditions physiologiques, la taille des pores de la structure en hydrogel, la façon d’amener les cellules à s’y coller, les mécanismes cellulaires en jeu ou encore, la stabilité du gel dans le milieu physiologique.
L’efficacité du dispositif est en cours de démonstration à l’étape in vitro. « Pour l’instant, les résultats obtenus sont bons. Nous sommes en mesure d’attirer des cellules cancéreuses grâce au chimio-attracteur et de les piéger dans l’hydrogel. Nous avons également constaté qu’avec une dose standard de radiations, il ne reste plus de cellules cancéreuses vivantes dans le piège », annonce Nick Virgilio. Les premiers essais in vivo sont prévus cet automne pour tester l’efficacité du procédé chez la souris.
Passage de la 2D à la 3D pour modèles cellulaires
Le Pr Virgilio, la Pre Faucheux et Pierre Sarazin emploient le même hydrogel pour développer des systèmes de culture cellulaire en 3D. « Dans l’industrie biopharmaceutique, les modèles cellulaires utilisés pour tester des médicaments sont typiquement en 2D. Or, dans ces milieux 2D, les cellules ne se comportent pas de la même façon que dans le milieu physiologique 3D du corps humain », explique-t-il. Selon la microstructure développée pour accueillir les cellules, ils ont pu observer que celles-ci se comportent de façon différente : elles forment soit des agrégats, soit des films, ou encore de longues structures allongées. En intervenant sur la chimie du gel, leur équipe est même en mesure d’amener des cellules souches à se différencier de façons différentes vers des lignées de cellules adipeuses, osseuses, ou encore cartilagineuses.
« Ultimement, nous visons à fournir aux sociétés biopharmaceutiques des modèles 3D plus représentatifs du comportement cellulaire dans le corps humain, afin qu’elles obtiennent un plus grand succès, par exemple, avec le criblage de médicaments », expose M. Virgilio, qui souligne que l’un des grands défis réside dans la capacité de produire ces modèles 3D en grande quantité et de les adapter à la chaîne d’analyse et de production de l’industrie.
Contrôler le développement des biofilms bactériens
Pre Marie-Claude Heuzey, du Département de génie chimique
La Pre Marie-Claude Heuzey, du Département de génie chimique, apporte son expertise en rhéologie (étude de la déformation et de l’écoulement de la matière) à divers projets multidisciplinaires liés aux biomatériaux.
Elle a ainsi supervisé une étude sur le développement et le contrôle des redoutables biofilms bactériens réalisée par son étudiante au doctorat Clémence Abriat, codirigée par le Pr Virgilio. L’équipe a utilisé la rhéologie interfaciale pour évaluer la cinétique de formation de deux biofilms abritant chacun deux espèces de bactéries. La rhéologie interfaciale, couplée à d’autres méthodes de caractérisation, a permis d’illustrer la dominance d’une des deux bactéries dans la formation du biofilm. Ces chercheurs ont aussi mis en contact des biofilms formés par la bactérie responsable du choléra avec des nanoparticules d’argent préparées par synthèse hydrothermale en présence de deux biopolymères, le chitosane (extrait de la carapace des crustacés) et l’alginate. « Nous avons pu observer qu’en fonction de la nature et de la taille des nanoparticules synthétisées, il est possible d’éradiquer ou du moins de limiter le développement des biofilms bactériens », rapporte la Pre Heuzey.
Chitosane électrofilé pour membranes antibactériennes
Fibres de chitosane électrofilé
Du fait de ses puissantes propriétés antimicrobiennes contre un large spectre de bactéries, levures et moisissures, le chitosane est un biopolymère biodégradable et biocompatible de grand intérêt. « Mais ses désavantages de taille sont sa fragilité à l’état de films obtenus à partir de solutions et l’absence de point de fusion qui restreint son usage dans les procédés industriels à l’état fondu », détaille la Pre Heuzey. Afin de tirer avantage des propriétés du chitosane, celle-ci, en collaboration avec le Pr Abdellah Ajji, travaille à sa mise sous forme de nanofibres grâce à un procédé d’électrofilage. « Ce procédé consiste à étirer le polymère en solution en le soumettant à un voltage à la sortie d’une seringue. Les fibres de très faible diamètre obtenues ont des avantages supérieurs aux films de chitosane grâce à leur grande surface exposée sous forme de mats. Ces structures peuvent servir de membranes antibactériennes utilisables dans un large éventail d’applications biomédicales et même agroalimentaires. »
Régénérer des articulations
Pr Marc Lavertu, du Département de génie chimique
Le Pr Marc Lavertu, du Département de génie chimique, est un spécialiste de la mise au point de biomatériaux pour la médecine régénératrice orthopédique. Son équipe de recherche développe des biomatériaux hydrides qui combinent une matrice polymérique et un produit orthobiologique autologue, afin de stimuler et d’améliorer la réparation de tissus musculosquelettiques, tels que les tendons et le cartilage. Il est co-inventeur, avec l’associée de recherche Anik Chevrier et les Prs Michael Buschmann et Caroline Hoemann, d’un biomatériau hybride dont l’entreprise Ortho Regenerative Technologies exploite aujourd’hui le brevet. Celle-ci a confié au Pr Lavertu le projet d’optimiser cette biotechnologie afin d’augmenter son efficacité thérapeutique et de faciliter son application pour le traitement des blessures musculosquelettiques.
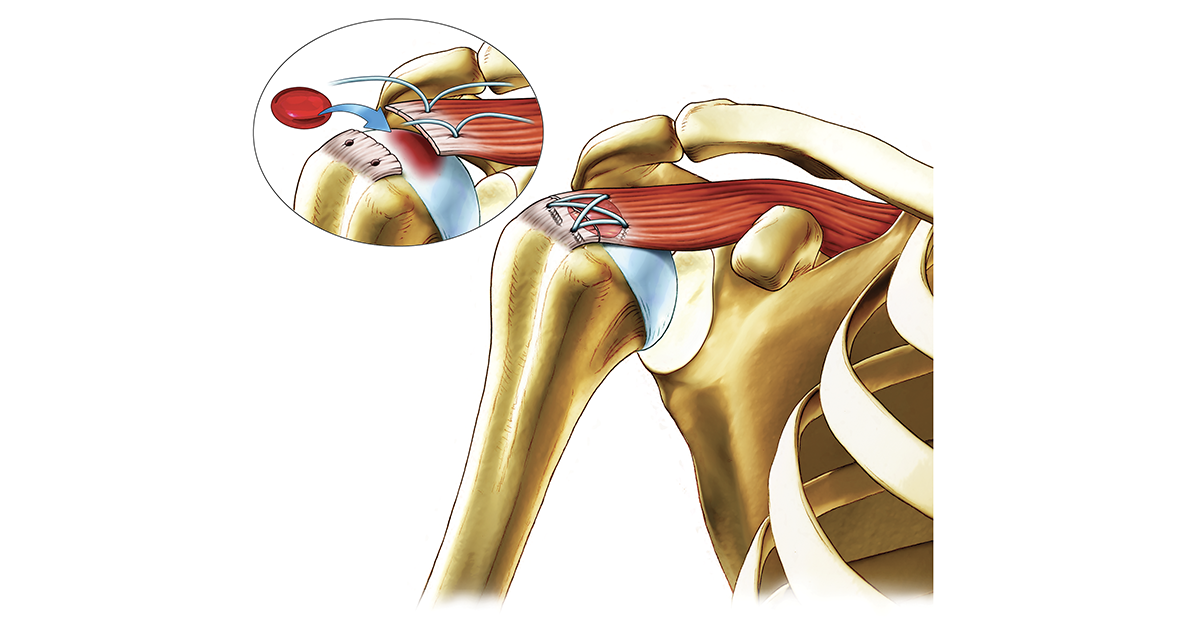
Intervention sur la coifffe des rotateurs avec application d'un biomatériau réparateur
« Ce biomatériau hybride est en quelque sorte un produit de deuxième génération. À l’origine, la composition intégrait une solution de glycérol-phosphate et de chitosane et du sang du patient. Bien qu’efficace pour la réparation du cartilage articulaire, cette formulation liquide avait une stabilité limitée. De plus, la longueur des chaînes de chitosane était significativement réduite par une nécessaire stérilisation par autoclave, explique le Pr Lavertu. Nous remplaçons maintenant le sang par un produit dérivé : du plasma riche en plaquettes (PRP) préparé par centrifugation du sang du patient, et nous employons une formulation à base de chitosane qui peut être stérilisée par filtration et lyophilisée, donc beaucoup plus stable. Au contact du produit lyophilisé, les plaquettes du PRP se dégranulent et libèrent les facteurs de croissance dont elles sont gorgées et qui agissent en synergie avec l’action réparatrice du chitosane sur les plaies. La préparation du mélange chitosane-PRP s’effectue durant l’intervention chirurgicale, suivie d’une période d’incubation d’une vingtaine de minutes, avant son injection et sa solidification in situ », détaille-t-il.
Ce procédé représente une stratégie d’augmentation : l’utilisation du biomatériau s’ajoute à l’intervention chirurgicale traditionnelle réalisée par le chirurgien orthopédiste pour stimuler la réparation. Il suffit au chirurgien d’injecter le produit dans les lésions. Dans le cas de déchirures de la coiffe des rotateurs (tendons de l’épaule), avec la technique classique seule, le tissu de réparation présente une structure fibreuse, éloignée de sa structure originelle et d’autres déchirures risquent de se produire ultérieurement. « Nos études précliniques montrent que d’un point de vue histologique, la structure obtenue avec l’utilisation de la biotechnologie est meilleure », ajoute le Pr Lavertu.
Ciblant en particulier la réparation de blessures musculosquelettiques parmi les plus fréquentes, celles de la coiffe des rotateurs, du ménisque et du cartilage du genou, la solution est sur le point d’être évaluée en clinique aux États-Unis.
Un tremplin du laboratoire à l’industrie pour des spécialistes en nanothérapies
Pr Gregory De Crescenzo, Département de génie chimique
Les nanomédicaments sont des systèmes nanométriques comprenant des molécules thérapeutiques transportées par des nanoparticules et visant à contrôler la libération des principes actifs et à cibler des cellules, tissus ou organes particuliers. Cette démarche thérapeutique est très en vogue, car elle permet, lors d’études cliniques réalisées auprès de petites cohortes de patients, d’obtenir une efficacité thérapeutique accrue tout en réduisant les effets secondaires des médicaments classiques. Malheureusement, ces innovations prometteuses ne sont pas facilement commercialisables, car mal adaptées aux plateformes de production à grande échelle. Malgré leur efficacité, un grand nombre de ces nanomédicaments sont donc abandonnés puisqu’ils sont trop coûteux, voire impossibles à produire à l’échelle industrielle. La recherche en amont n’est alors qu’un coup d’épée dans l’eau.
Pour y remédier, le Pr Gregory De Crescenzo, du Département de génie chimique, et le Pr Xavier Banquy, de la Faculté de pharmacie de l’UdeM, ont mis sur pied et codirigent un programme de formation aux cycles supérieurs unique au Québec, voué à la formation de spécialistes en nanomédicaments, capables d’aborder une stratégie thérapeutique à la fois du point de vue pharmaceutique et de celui du génie des procédés, couvrant ainsi les étapes allant de la mise au point d’une nouvelle molécule jusqu’à sa production à grande échelle par l’industrie. Nommée PrEEmiuM (pour Process Engineering of Emerging Nano-Medicines), cette formation sur mesure soutenue par le programme FONCER du Conseil de recherches en sciences naturelles du Canada (CRSNG) offre aux étudiants en génie chimique et en pharmacie un environnement résolument multidisciplinaire. La formation PrEEmiuM est aussi enrichie par de multiples ateliers et activités sur mesure donnés par l’Institut TransMedTech, afin de sensibiliser les étudiants aux aspects légaux mais aussi aux problématiques des équipes médicales en lien avec l’utilisation de cette nouvelle classe de médicaments.
Pr Xavier Banquy, Faculté de pharmacie de l'Université de Montréal
« Un point clé de la formation est que chaque étudiant en génie est jumelé avec un étudiant de la Faculté de pharmacie, et chacun doit suivre des cours dans la discipline qu’il ne connaît pas, de façon à apprendre le langage de l’autre. En comprenant à la fois les enjeux de l’innovation thérapeutique et les rouages de l’industrie pharmaceutique, ces futurs spécialistes seront en mesure d’établir des stratégies efficaces et viables économiquement, favorisant ainsi l’avènement de nouveaux types de traitements que l’industrie pourra produire à grande échelle à coût raisonnable, et dont les patients pourront bénéficier plus rapidement », explique le Pr De Crescenzo.
« À la suite de la pandémie, le gouvernement fédéral a décidé de soutenir des sociétés de développement ou de fabrication de vaccins innovants. Mais il manque des forces vives hautement qualifiées pour gérer leurs activités. Les firmes qui développent des thérapies géniques font face à la même pénurie. Nous formons une relève apte à répondre à ce besoin », ajoute son confrère, le Pr Banquy.
Un axe important du programme PrEEmiuM est effectivement consacré au développement de solutions permettant de libérer des produits biologiques instables, mais qui doivent être adaptées à la production à grande échelle. Des procédés de production de nouveaux vaccins, qu’ils soient à base de particules pseudovirales (Novavax) ou à ARN messager encapsulé (Moderna, Pfizer), sont, entre autres, visés par cet axe, de même que la nanoformulation de thérapies conjuguant différentes molécules médicamenteuses à des anticorps pour traiter plus efficacement des maladies comme le cancer.
Administration de molécules actives et implants vascularisables
Dans son laboratoire, Gregory De Crescenzo consacre certains de ses projets à la fabrication de nanomatériaux destinés au transport de molécules actives. Il s’intéresse aussi au design sur mesure de nanomédicaments résultant de l’assemblage de plusieurs molécules complexes, en cherchant à augmenter l’efficacité des procédés pour obtenir ces structures nanométriques. La mise au point de matériaux capables de libérer progressivement des molécules actives pour traiter une inflammation ou un cancer, font partie de ses projets. De plus, il participe aux projets du Pr Xavier Banquy reliés au développement de technologies de régénération du cartilage.
« Je conçois également des biomatériaux de plus grande taille destinés à la réalisation d’implants complètement biocompatibles et vascularisables, capables de guider la croissance des cellules afin de régénérer les tissus. Par exemple, je collabore étroitement avec le Pr Nick Virgilio pour développer des matrices très poreuses à base de polysaccharides naturels », mentionne-t-il. Ce type de projet de génie tissulaire vise à favoriser la reconstruction de tissus complexes et fonctionnels.
De nouveaux nanomatériaux s’invitent dans des outils de diagnostic

Pre Géraldine Merle, titulaire de la Chaire de recherche TransMedTech en technologies diagnostiques et thérapeutiques
Le temps est un facteur critique pour les chances de guérison d’un patient, en particulier dans le cas du cancer. L’obtention d’un diagnostic immédiat et fiable lors d’une intervention permettrait au chirurgien de prendre tout de suite une décision sans avoir à envoyer un échantillon en analyse. Grâce à la mesure du transfert d'électrons entre une biomolécule, ou un biomarqueur, et des nanomatériaux à la surface de l'électrode, à une tension spécifique, un tissu malade peut être distingué d’un tissu sain. La Pre Géraldine Merle, du Département de génie chimique, a fait de cette approche bioélectrochimique un des axes majeurs de la Chaire de recherche TransMedTech en technologies diagnostiques et thérapeutiques dont elle est titulaire.
« Nous développons des nanostructures pour concevoir des dispositifs portatifs de très petite taille et peu invasifs. Ce sont des outils de diagnostic électromoléculaire, par exemple, des sondes électrochimiques détectant des molécules contenant des ions métalliques présents dans les protéines que les cellules cancéreuses ou des bactéries surexpriment », précise-t-elle.
Traitements antibactériens sans antibiotiques et « rustine » pour le cœur
L’équipe de sa chaire emploie aussi des nanomatériaux synthétiques pour réaliser des solutions de traitement des infections bactériennes sans traitement antibiotique. Parmi ses projets : des fils pour les sutures, des bandages, des gazes et des pansements qui permettent de prévenir le dépôt d’un biofilm et d'éliminer plus de 90 % des bactéries.
« Certains de nos projets en collaboration avec des professeurs du Département de génie chimique visent également le développement de ligaments artificiels réalisés par tissage de polymère et de biomolécules », indique Mme Merle, dont l’équipe explore aussi une technologie qui trouve une application dans les timbres cardiaques. « Le tissu cardiaque endommagé ne transmet plus les impulsions électriques qui donnent au cœur son mouvement. Le timbre se colle alors sur le cœur et relance ses impulsions. »
Les biotechnologies qui voient le jour grâce aux propriétés de tous ces nouveaux matériaux pourraient-elles un jour non plus seulement réparer mais remplacer ou augmenter les fonctions du corps humain? La chercheuse en doute. « On ne pourra jamais faire mieux que la nature, on ne peut que s’en approcher. »


 disponible (Été 2021)
disponible (Été 2021)